ENTRADA 4
ESTE SE
REFIERE A QUE NOS PODEMOS ENCONTRAR CON REACCIONES QUÍMICAS SON REVERSIBLES Y
PARA QUE ESTAS PUEDAN ESTAR EN EQUILIBRIO, LAS VELOCIDADES DE REACCIÓN DIRECTA
O INVERSA DEBEN ESTAR IGUALES.
CUANDO LA
REACCIÓN SE ENCUENTRA EN EQUILIBRIO ESTA SE DESPLAZA MAS A LA DERECHA, DEBIDO A
QUE CASI A UTILIZADO TODOS LOS REACTIVOS Y SI SE ENCUENTRA A LA IZQUIERDA ES
POR QUE SOLO SE FORMARA ALGO DE PRODUCTO APARTAR DE LOS REACTIVOS
PARA
COMPRENDER MEJOR ESTO ES NECESARIO RECORDAR Y MANEJAR MUY BIEN LAS REGLAS:
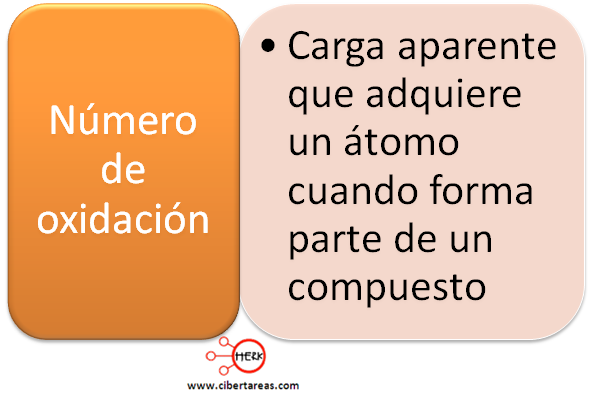
NUMERO DE
OXIDACIÓN:

1. DESARROLLA LA ESTRUCTURA DE LEWIS EN CUESTIÓN,
UTILIZANDO EL NUMERO DE ELECTRONES QUE HAYA EN LA CAPA DE VALENCIA DE CADA
ELEMENTO (ev).
2. ASIGNA A LA ESPECIE MAS ELECTRONEGATIVA LOS ELECTRONES
QUE FORMAN EL ENLACE.
3. EN ENLACES COVALENTES PUROS, DIVIDE EQUITATIVAMENTE
LOS ELECTRONES.
4. CUENTA EL NUMERO DE ELECTRONES ASIGNADOS A CADA
ESPECIE SEGÚN SU ELECTRONEGATIVIDAD (ea).
5. EL NUMERO DE OXIDACIÓN SE OBTIENE RESTANDO EL NUMERO
DE ELECTRONES ASIGNADOS (ea) A ELECTRONES DE VALENCIA.

BALANCEO DE REACCIONES OXIDO-REDUCCIÓN
EN ESTE
SE LLEVA A CABO CUANDO SE PRODUCE UN CONJUNTO DE ELEMENTOS QUÍMICOS, UNO
OXIDANTE Y OTRO REDUCTOR (ES DECIR UNA FORMA REDUCIDA Y OTRA OXIDADA), PARA ASÍ
DEBIDO A LA ENERGÍA LIBERADA SE PUEDA CONVERTIR EN ELECTRICIDAD
PARA
DICHO BALANCEO SE DEBE OCUPAR EL MÉTODO ION-ELECTRÓN DONDE LA REACCIÓN
SE DIVIDE EN DOS SEMIREACCIONES, 8 UNA DE OXIDACIÓN Y OTRA DE REDUCCIÓN). PERO
PARA ANTES DE EMPEZAR A BALANCERO SE TIENE QUE DETERMINAR EN QUE MEDIO OCURRE
LA REACCIÓN, DEBIDO A QUE PARA CADA MEDIO PROCEDE O ACTÚA DE DIFERENTE MANERA.
YA SEA
POR UN MEDIO ACIDO
O MEDIO
ALCALINO.

BALANCEO POR MÉTODO REDOX
ESTE
TAMBIÉN SE CONOCE POR EL MÉTODO DE NUMERO DE OXIDACIÓN.
ESTE
BALANCEO TAMBIÉN SE DA CUANDO NO ES POSIBLE IDENTIFICAR A LAS MISMAS SUSTANCIAS
ANTES Y DESPUÉS DE PRODUCIRSE LA REACCIÓN QUÍMICA, YA QUE ESTOS SE CONSUMEN PARA
DAR PASO A LOS PRODUCTOS.
ESTA REACCIÓN
SE DA CUANDO COLISIONAN LAS PARTÍCULAS YA SEAN MOLÉCULAS, ÁTOMOS O IONES, PERO TAMBIÉN
SE PUDE LLEVAR A CABO POR EL CHOQUE DE ALGUNAS MOLÉCULAS CON OTRO TIPO DE PARTÍCULAS
COMO ELECTRONES O FOTONES
SUS PASOS A
SEGUIR SON:
1-ESCRIBIR
LA REACCIÓN COMPLETA
2- INDICAR
EL NUMERO DE OXIDACIÓN DE CADA ELEMENTO QUE PARTICIPA EN LA REACCIÓN
3-IDENTIFICAR
LA REACCIÓN DE OXIDACIÓN Y LA DE REDUCCIÓN
4-IDENTIFICAR
EL AGENTE OXIDANTE Y EL AGENTE REDUCTOR
5-AJUSTAR
LA TRANSFERENCIA DE ELECTRONES, DE FORMA QUE EL NUMERO DE ELECTRONES CEDIDOS SEA
IGUAL AL NUMERO DE ELECTRONES GANADOS
6-BALANCEAR
LAS REACCIONES POR TANTEO.
Comentarios
Publicar un comentario