ENTRADA 6

ELECTROLISIS
ESTA SE REFIERE A LOS PROCESOS QUE SE REALIZAN A LOS PROCESOS QUE SE REALIZAN EN LAS
CELDAS ELECTROQUÍMICAS (ES DECIR LAS PILAS), Y COMO UTILIZAN EL PROCESOS DE LAS
PILAS ESTE TAMBIÉN REQUIERE DE DOS ELECTRODOS, UNO POSITIVO Y OTRO NEGATIVO, ASÍ
COMO SUSTANCIAS QUE CONDUZCAN LA CORRIENTE ELÉCTRICA.
.
ELECTROLISIS
DEL AGUA
EN ESTA
SI EL AGUA ESTA DESTILADA NO SOLO PUEDE SEPARA EL OXIGENO Y EL HIDROGENO, AL CONTRARIO,
TAMBIÉN PUEDE SEPARAR MAS COMPONENTES QUE SE ENCUENTREN PRESENTES COMO SALES,
METALES, Y ALGUNOS OTROS MINERALES.
ES
IMPORTANTE SABES ESTO:
l NUCA DEBEN UNIRSE LOS ELECTRODOS, YA QUE LA CORRIENTE ELÉCTRICA
NO VA A CONSEGUIR EL PROCESO Y LA BATERÍA SE SOBRECALENTARÁ Y QUEMARÁ.
l DEBE UTILIZARSE SIEMPRE CORRIENTE CONTINUA, NUNCA
CORRIENTE ALTERNA.

l PARA PRODUCIR AGUA OTRA VEZ ES MEDIANTE UN
CATALIZADOR.
CORROSIÓN

SE REFIERE
AL DETERIORO DE LOS METALES
UN CASO
MUY COMÚN SERIA EL HIERO, QUE CUENTA CON OXIDO DE HIERRO QUE ALISTAR EN
CONTACTO CON EL OXIGENO ESTE CAUSA QUE TANTO SUS PROPIEDADES FÍSICAS COMO QUÍMICAS,
VAYAN OBTENIENDO DIFERENTES CARACTERÍSTICAS, PARA ASÍ INICIAR EL PROCESO DE OXIDACIÓN,
SI ESTE NO SE PROTEGE, UNA MANERA DE PROTEGER LOS METALES SERIA IMPERMEABILIZÁNDOLOS,
PARA ASÍ EVITAR LA OXIDACIÓN.
LA CORROSIÓN
SE PUEDE CLASIFICAR DE ACUERDO A LA APARIENCIA DEL METAL.
a) CORROSIÓN UNIFORME: donde la corrosión química o electrolítica actúa
uniformemente sobre toda la superficie del metal.
b) CORROSIÓN GALVÁNICA: ocurre cuando metales diferentes se encuentran en contacto,
ambos metales posen potenciales eléctricos diferentes, lo cual favorece la aparición
de un metal como ánodo y otro como cátodo, a mayor diferencia del potencial el
material con más activo será el ánodo.
c) CORROSIÓN POR PICADURAS: aquí se producen hongos o agujeros por agentes químicos.
Corrosión intergranular: es la que se encuentra localizada en los límites del
grano, este origina perdidas en la resistencia que desintegran los bordes de
los granos.
d) CORROSIÓN POR ESFUERZO: se refiere a las tensiones internas luego de una
deformación en frio.

Otro
ejemplo de oxidación
ESTA ES
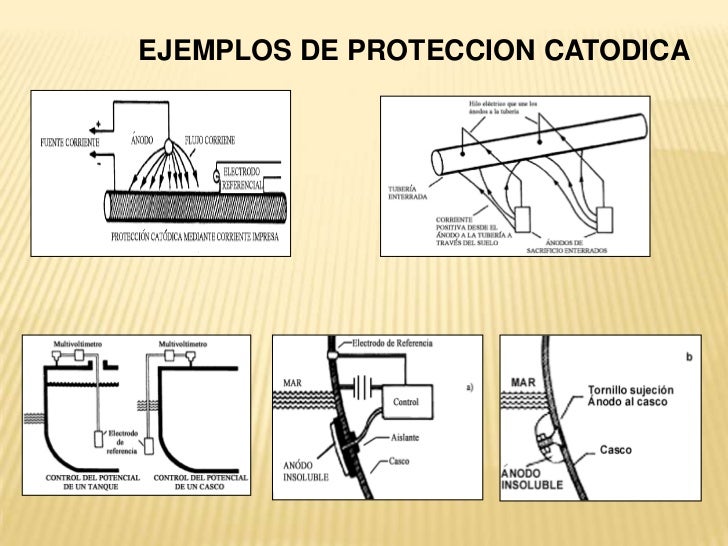
UNA TÉCNICA QUE SE UTILIZA PARA CONTROLAR LA CORROSIÓN DE METALES, ES UN MÉTODO
SENCILLO PARA PROTEGER LOS METALES, PERO ESTE SE HACE CON OTRO METAL ACTUANDO
COMO ÁNODO.
ESTE
SISTEMA CATÓDICO ES EL QUE SE USA MAS COMÚNMENTE PARA PARA PROTEGER EL ACERO,
EL AGUA O DE COMBUSTIBLE EL TRANSPORTE POR TUBERÍAS Y TANQUES DE ALMACENAMIENTO,
BARCOS, O UNA PLATAFORMA PETROLÍFERA, TANTO DENTRO DEL MAR COMO FUERA DE EL.
ESTA PROTECCIÓN
PUEDE IMPEDIR LA CORROSIÓN GALVÁNICA.
LA CP. (PROTECCIÓN CATÓDICA) SE PUDE REALIZAR
DE DIFERENTES FORMAS CON ALEACIÓN DE ZINC, MAGNESIO Y ALUMINIO.
ESTOS ÁNODOS
SON DISEÑADOS Y SELECCIONADOS PARA TENER UNA TENSIÓN MAS ACTIVA.
PARA QUE
LA PROTECCIÓN CATÓDICA PUEDA FUNCIONAR, EL ÁNODO DEBE TENER UN POTENCIAL MENOR
(ES DECIR, MAS NEGATIVO) QUE EL POTENCIAL DEL CÁTODO (LA ESTRUCTURA A PROTEGER)

Lucky Club Casino Site - Best Winning Online Casinos
ResponderBorrarLucky Club Casino Review. Read our honest and unbiased Lucky Club Casino review. Find out more about luckyclub.live the site and its promotions, Rating: 7/10 · Review by LuckyClub.org